- 硼的性质及分类
 硼:元素符号B,原子序数5,原子量10.81,位于第二周期第ⅢA族。单质硼有多种同素异形体,可分为无定形硼和晶形硼等多种变体,晶形硼又有四方形硼、α 菱形硼、β 菱形硼等8种变体。 熔点2076℃。沸点3927℃。无定形硼为黑色或深棕色粉末,晶体硼呈灰黑色。单质硼的硬度仅次于金刚石,质地较脆,硼有很低的蒸气压和很高的电阻率,其电阻率随温度升高而迅速降低。因此,硼在常温(室温)时为弱电导体,而在高温时则为良导体。
硼:元素符号B,原子序数5,原子量10.81,位于第二周期第ⅢA族。单质硼有多种同素异形体,可分为无定形硼和晶形硼等多种变体,晶形硼又有四方形硼、α 菱形硼、β 菱形硼等8种变体。 熔点2076℃。沸点3927℃。无定形硼为黑色或深棕色粉末,晶体硼呈灰黑色。单质硼的硬度仅次于金刚石,质地较脆,硼有很低的蒸气压和很高的电阻率,其电阻率随温度升高而迅速降低。因此,硼在常温(室温)时为弱电导体,而在高温时则为良导体。 硼在1073K温度以下为无定型硼(密度2.3g/cm³),在1073~1373K温度时为a菱形硼(密度2.46g/cm³),在1370~1573K温度时为口四方硼(密度2.3g/cm³),超过1573K时p菱形硼(密度2.34g/cm³)。
硼在1073K温度以下为无定型硼(密度2.3g/cm³),在1073~1373K温度时为a菱形硼(密度2.46g/cm³),在1370~1573K温度时为口四方硼(密度2.3g/cm³),超过1573K时p菱形硼(密度2.34g/cm³)。 - 硼共价半径82皮米,离子半径20皮米,电离势800.0千焦/摩尔,电负性2.0,主要氧化数+3。无定形硼密度2.3g/cm³,晶形硼密度随温度变化而不同。单质硼晶体是由B-12正二十面体的基本结构单元组成的。结晶硼属于原子晶体,因此,结晶硼的硬度大,熔点、沸点高。
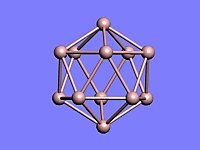 晶态单质硼有多种变体,它们都以B12正二十面体为基本的结构单元。这个二十面体由12个B原子组成,20个接近等边三角形的棱面相交成30条棱边和12个角顶,每个角顶为一个B原子所占据。由于B12二十面体的连接方式不同,键也不同,形成的硼晶体类型也不同。其中最普通的一种为α-菱形硼。
晶态单质硼有多种变体,它们都以B12正二十面体为基本的结构单元。这个二十面体由12个B原子组成,20个接近等边三角形的棱面相交成30条棱边和12个角顶,每个角顶为一个B原子所占据。由于B12二十面体的连接方式不同,键也不同,形成的硼晶体类型也不同。其中最普通的一种为α-菱形硼。- α-菱形硼是由B12单元组成的层状结构,α-菱形硼晶体中既有普通的σ键,又有三中心两电子键。许多B原子的成键电子在相当大的程度上是离域的,这样的晶体属于原子晶体,因此晶态单质硼的硬度大,熔点高,化学性质也不活泼。
- 在α-菱形硼晶格中,每个二十面体通过处在腰部的6个B原子以三中心两电子键与在同一平面内的相邻的6个二十面体连接起来(其中虚线三角形表示三中心两电子键,键距203pm)。这种二十面体组成的片层,层面结合靠的是二十面体的上下各3 个B原子以6个正常的B-B共价键(即两中心两电子键,键长171pm)同上下两层的6个附近的二十面体相连接,3个在上一层,3个在下一层。
- 在硼的二十面体结构单元中,B12的36个电子是如下分配的:在二十面体内有13个分子轨道,用去26个电子;每个二十面体同上下相邻的6个二十面体形成6个两中心两电子共价键,用去了6个电子;在二十面体腰部的6个B原子与同平面上周围相邻的6个三中心两电子键,用去了6×2/3=4个电子,结果总电子数是26+6+4=36。所有电子都已用于形成复杂的多面体结构。
- 硼是元素周期表第三主族唯一的非金属元素,B原子的价电子结构是2s22p1,它能提供成键的电子是2s2p,还有一个空轨道。这种B原子的价电子少于价轨道数的缺电子情况,但硼与同周期的金属元素锂,铍相比原子半径小,电离能高,电负性大,以形成共价键分子为特征。
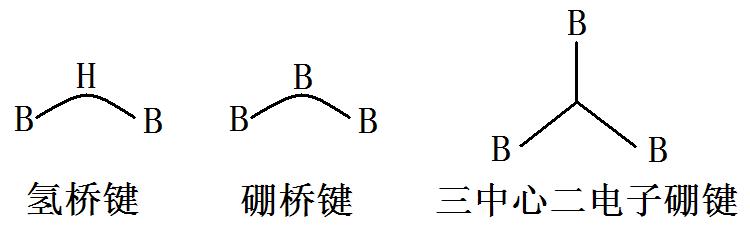
- 在硼原子以sp2杂化形成的共价分子中,余下的一个空轨道可以作为路易斯酸,接受外来的孤对电子,形成以sp3杂化的四面体构型的配合物。例如三氟化硼与氨气分子形成的配合物;若没有合适的外来电子,可以自相聚合形成缺电子多中心键,例如三中心二电子氢桥键、三中心二电子硼桥键、三中心二电子硼键。
- 需要注意的是桥键与三中心二电子间的不同。硼桥键中心的硼原子是P轨道与两个杂化轨道的重叠,氢桥键中心的氢原子是S轨道与两个杂化轨道的重叠,而三中心二电子硼键为三个杂化轨道的组合重叠。
 硼的化学性质和形态有关,纯的晶形硼在室温的空气中几乎不起化学变化;而无定形硼在空气中可缓慢地氧化,高温下燃烧生成氧化硼。在高温下硼易和各种气体剧烈反应,晶形硼在1023K温度下不与氧反应,无定形硼粉在973K温度下便开始和氧反应。晶形硼在373K温度下不与水作用,无定形硼在373K温度下便和水慢慢反应。晶形硼不与稀硝酸作用,与热浓硝酸反应缓慢;无定形硼和稀硝酸缓慢反应,和热浓硝酸剧烈反应。硼在盐酸或氢氟酸中长期煮沸也不发生变化,但可分别被Hzoz、王水、浓硫酸和硝酸之比为2:1的混合酸缓慢氧化为硼酸。硼在1123K温度下与碳酸钠或碳酸钠和硝酸钠的混合物共熔,可被氧化为硼酸盐。硼跟氢氧化钠溶液反应生成偏硼酸钠并放出氢气 。过二硫酸铵和高碘酸钾溶液也可缓慢溶解硼。硼能与卤素直接化合,生成卤化硼BX3。氟在室温下,氯、溴、碘分别在673K、873和973K温度下与硼发生作用。硼在873K~1273K(600~1000°C)温度下与硫、硒、磷、砷反应;在1273~1673K(1000~1400°C)温度下与氮、碳、硅作用,分别生成氮化硼BN、碳化硼B2C3及硅化硼B4Si和B6Si。高温下硼能与许多金属或金属氧化物反应,生成金属硼化物。这些金属硼化物(包括碳、氮硼化物)一般都具有很高的熔点和硬度。粉末状的硼能溶于沸硝酸和硫酸,以及大多数熔融的金属如铜、铁、锰、铝和钙。
硼的化学性质和形态有关,纯的晶形硼在室温的空气中几乎不起化学变化;而无定形硼在空气中可缓慢地氧化,高温下燃烧生成氧化硼。在高温下硼易和各种气体剧烈反应,晶形硼在1023K温度下不与氧反应,无定形硼粉在973K温度下便开始和氧反应。晶形硼在373K温度下不与水作用,无定形硼在373K温度下便和水慢慢反应。晶形硼不与稀硝酸作用,与热浓硝酸反应缓慢;无定形硼和稀硝酸缓慢反应,和热浓硝酸剧烈反应。硼在盐酸或氢氟酸中长期煮沸也不发生变化,但可分别被Hzoz、王水、浓硫酸和硝酸之比为2:1的混合酸缓慢氧化为硼酸。硼在1123K温度下与碳酸钠或碳酸钠和硝酸钠的混合物共熔,可被氧化为硼酸盐。硼跟氢氧化钠溶液反应生成偏硼酸钠并放出氢气 。过二硫酸铵和高碘酸钾溶液也可缓慢溶解硼。硼能与卤素直接化合,生成卤化硼BX3。氟在室温下,氯、溴、碘分别在673K、873和973K温度下与硼发生作用。硼在873K~1273K(600~1000°C)温度下与硫、硒、磷、砷反应;在1273~1673K(1000~1400°C)温度下与氮、碳、硅作用,分别生成氮化硼BN、碳化硼B2C3及硅化硼B4Si和B6Si。高温下硼能与许多金属或金属氧化物反应,生成金属硼化物。这些金属硼化物(包括碳、氮硼化物)一般都具有很高的熔点和硬度。粉末状的硼能溶于沸硝酸和硫酸,以及大多数熔融的金属如铜、铁、锰、铝和钙。- 硼与金属、非金属作用,与酸作用,与强碱作用的情况总结如下:
- (1)与非金属作用
- 高温下B能与N₂、O₂、S、X₂等单质反应,例如它能在空气中燃烧生成B₂O₃和少量BN,在室温下即能与F₂发生反应,但它不与H₂、稀有气体等作用。
- (2)B能从许多稳定的氧化物(如SiO₂,P₂O₅,H₂O等)中夺取氧而用作还原剂。例如在赤热下,B与水蒸气作用生成硼酸和氢气:2B+6H₂O=高温=2H₃BO₃+3H₂
- (3)与酸作用
- 硼不与盐酸作用,但与热浓H₂SO₄,热浓HNO₃作用生成硼酸:
- 2B+3H₂SO₄(浓)==2H₃BO₃+3SO₂↑
- B+3HNO₃(浓)==H₃BO₃+ 3NO₂↑
- (4)与强碱作用
- 在氧化剂存在下,硼和强碱共熔得到偏硼酸盐:
- 2B+2NaOH+3KNO₃==2NaBO₂+3KNO₂+H₂O
- (5)与金属作用
- 高温下硼几乎能与所有的金属反应生成金属硼化物。它们是一些非整比化合物,组成中B原子数目越多,其结构越复杂。
- 硼共有14种同位素,其中只有两个是稳定的(硼10和硼11),其他同为素(均带有放射性)包括硼6,硼7,硼8,硼9,硼12,硼13,硼14,硼15,硼16,硼17,硼18,硼19。天然存在的硼由两种稳定的同位素硼-10(19.78%)和硼-11(80.22%)组成(维基百科硼10 -19.9%, 硼11-80.1%)。
- 目录
Boron
- 介绍
- 发现
- 性质
- 制备工艺
- 应用
- 资源分布
- 中国资源
- 化合物
- 硼烷
- 硼酸
- 毒性作用
- 健康
- 动植物
- 行业标准
- 名企
- 矿物
- 推荐
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- 涨 ▪ 知识
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | ||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
1 氢 |
2 氦 |
||||||||||||||||||||||||||||||
3 |
4 铍 |
5 硼 |
6 碳 |
7 氮 |
8 氧 |
9 氟 |
10 氖 |
||||||||||||||||||||||||
11 钠 |
12 |
13 |
14 |
15 磷 |
16 硫 |
17 氯 |
18 氩 |
||||||||||||||||||||||||
19 钾 |
20 |
21 |
22 |
23 |
24 |
25 |
26 铁 |
27 |
28 |
29 |
30 |
31 |
32 |
33 |
34 |
35 溴 |
36 氪 |
||||||||||||||
37 铷 |
38 |
39 |
40 |
41 |
42 |
43 锝 |
44 钌 |
45 铑 |
46 钯 |
47 银 |
48 |
49 |
50 |
51 |
52 |
53 碘 |
54 氙 |
||||||||||||||
55 铯 |
56 钡 |
57 |
58 |
59 |
60 |
61 |
62 |
63 |
64 |
65 |
66 |
67 |
68 |
69 |
70 |
71 |
72 铪 |
73 |
74 |
75 |
76 锇 |
77 铱 |
78 铂 |
79 金 |
80 |
81 铊 |
82 |
83 |
84 钋 |
85 砹 |
86 氡 |
87 钫 |
88 镭 |
89 锕 |
90 钍 |
91 镤 |
92 铀 |
93 镎 |
94 钚 |
95 镅 |
96 锔 |
97 锫 |
98 锎 |
99 锿 |
100 镄 |
101 钔 |
102 锘 |
103 铹 |
104 鑪 |
105 Db |
106 Sg |
107 Bh |
108 Hs |
109 Mt |
110 鐽 |
111 錀 |
112 Cn |
113 Uut |
114 Fl |
115 Uup |
116 Lv |
117 Uus |
118 Uuo |





