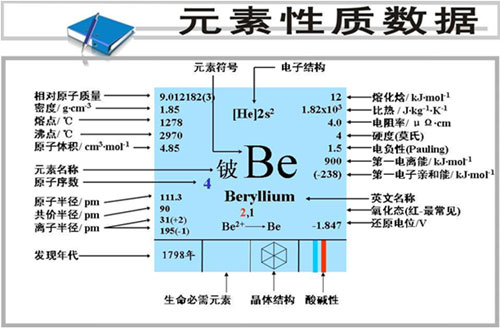
- 铍的性质
- 铍是轻稀有金属,原子序数小,密度低(只有1.847g/cm³) , 约为铝的2/3,钛的1/2。熔b点较高(1283℃)。铍在室温条件下为α-Be,具有密排六方结构;在1254℃时发生相转变,为β-Be 结构。铍是所有金属中热容量最大的一种金属。室温下比热容为1.8828 J/gK,铍比其它金属吸收的热量多,这一特性一直保持到熔点。铍在室温下的热导率为0.15kW/(m.K)。铍的热膨胀系数与不锈钢、Ni-Co合金相当;热扩散性能也很好。
- 铍对可见光的反射率为50%,对紫外线的反射率为55%,对红外线(10.6m) 的反射率为98%。对X射线穿透率很高(几乎是透明的),约为铝的17倍, 是X射线窗口不可缺少的材料。
- 铍的弹性模量很高(309000 MPa),大约是铝的4倍,钛的2.5倍,钢的1.5倍。特别是从室温到615℃的温度范围内,比刚度大约是钢、铝、钛的6倍。另外,铍的热中子吸收率是所有金属中最小的,而散射截面很大。
- 此外,铍是钢灰色金属轻金属。铍的硬度比同族金属高,不像钙、锶、钡可以用刀子切割。
 铍是非常活泼的金属,与氧的亲和力很大,室温条件下就能与氧反应在其表面生成一薄层具有保护性质的氧化膜。当温度小于600℃时铍在干燥空气中,可长时间氧化,高于 600℃氧化速度将逐渐加快。温度达800℃,短时停留时,其氧化的程度反而并不太严重。
铍是非常活泼的金属,与氧的亲和力很大,室温条件下就能与氧反应在其表面生成一薄层具有保护性质的氧化膜。当温度小于600℃时铍在干燥空气中,可长时间氧化,高于 600℃氧化速度将逐渐加快。温度达800℃,短时停留时,其氧化的程度反而并不太严重。- 可见,铍和锂一样,在空气中形成保护性氧化层,故在空气中即使红热时也很稳定。不溶于冷水,微溶于热水,可溶于稀盐酸,稀硫酸和氢氧化钾溶液而放出氢。金属铍对于无氧的金属钠即使在较高的温度下,也有明显的抗腐蚀性。铍价态为正2价,可以形成聚合物以及具有显著热稳定性的一类共价化合物。
- 铍的反常性质
- Be原子的价电子层结构为2s(2),它的原子半径为89pm,Be(2+)离子半径为31pm,Be的电负性为1.57。铍由于原子半径和离子半径特别小(不仅小于同族的其它元素,还小于碱金属元素),电负性又相对较高(不仅高于碱金属元素,也高于同族其它各元素),所以铍形成共价键的倾向比较显著,不像同族其它元素主要形成离子型化合物。因此铍常表现出不同于同族其它元素的反常性质。
- (1)铍由于表面易形成致密的保护膜而不与水作用,而同族其它金属镁、钙、锶、钡均易与水反应。
- (2)氢氧化铍是两性的,而同族其它元素的氢氧化物均是中强碱或强碱性的。
- (3)铍盐强烈地水解生成四面体型的离子[Be(H2O)2]2+,Be-O键很强,这就削弱了O-H键,因此水合铍离子有失去质子的倾向:
- 因此铍盐在纯水中是酸性的。而同族其它元素(镁除外)的盐均没有水解作用。
- 目录
Beryllium
- 介绍
- 历史发展
- 性质
- 资源储量
- 应用
- 提取工艺
- 健康影响
- 行业标准
- 名企
- 推荐
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | ||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
1 氢 |
2 氦 |
||||||||||||||||||||||||||||||
3 |
4 铍 |
5 硼 |
6 碳 |
7 氮 |
8 氧 |
9 氟 |
10 氖 |
||||||||||||||||||||||||
11 钠 |
12 |
13 |
14 |
15 磷 |
16 硫 |
17 氯 |
18 氩 |
||||||||||||||||||||||||
19 钾 |
20 |
21 |
22 |
23 |
24 |
25 |
26 铁 |
27 |
28 |
29 |
30 |
31 |
32 |
33 |
34 |
35 溴 |
36 氪 |
||||||||||||||
37 铷 |
38 |
39 |
40 |
41 |
42 |
43 锝 |
44 钌 |
45 铑 |
46 钯 |
47 银 |
48 |
49 |
50 |
51 |
52 |
53 碘 |
54 氙 |
||||||||||||||
55 铯 |
56 钡 |
57 |
58 |
59 |
60 |
61 |
62 |
63 |
64 |
65 |
66 |
67 |
68 |
69 |
70 |
71 |
72 铪 |
73 |
74 |
75 |
76 锇 |
77 铱 |
78 铂 |
79 金 |
80 |
81 铊 |
82 |
83 |
84 钋 |
85 砹 |
86 氡 |
87 钫 |
88 镭 |
89 锕 |
90 钍 |
91 镤 |
92 铀 |
93 镎 |
94 钚 |
95 镅 |
96 锔 |
97 锫 |
98 锎 |
99 锿 |
100 镄 |
101 钔 |
102 锘 |
103 铹 |
104 鑪 |
105 Db |
106 Sg |
107 Bh |
108 Hs |
109 Mt |
110 鐽 |
111 錀 |
112 Cn |
113 Uut |
114 Fl |
115 Uup |
116 Lv |
117 Uus |
118 Uuo |





